2018.08.03
彰基罕病電子報 電子報(第十六期)--Spinal muscular atrophy 脊髓性肌肉萎縮症
週電子報 (N20180803) 2018/08/03出刊
1.罕病介紹
◎ ICD-10-CM診斷代碼:G12.9 Spinal muscuiar atrophy 脊髓性肌肉萎縮症
疾病機轉 / 臨床表現
脊髓性肌萎縮是一種影響肌肉運動控制的遺傳性疾病。是運動神經元的喪失引起的在脊髓和連接到脊髓大腦的部分。運動神經元的喪失導致虛弱和萎縮,用於爬行、行走、坐起和控制頭部運動等活動的肌肉,在嚴重的脊髓性肌萎縮病例中,呼吸和吞嚥的肌肉會受到影響。有許多類型的脊髓性肌萎縮,以肌肉問題開始時的特徵模式,肌肉無力的嚴重程度和年齡來區分。
I型脊髓性肌萎縮症,也稱為Werdnig-Hoffman病,是一種嚴重的疾病形式,在出生時或出生後的頭幾個月內是明顯的,受影響的嬰兒會有發育遲緩、呼吸和吞嚥問題,可能導致窒息或嘔吐。
II型脊髓性肌萎縮的特徵是肌肉無力,在6至12個月的兒童中發展。II型兒童可以在沒有支撐的情況下坐著,儘管他們可能需要幫助才能坐到位。患有這種脊髓性肌萎縮症的人不能獨立站立或行走。
III型脊髓性肌萎縮症,也稱為Kugelberg-Welander病或幼年型,具有較輕微的特徵,通常發生在兒童早期和青春期之間。患有III型脊髓性肌萎縮症的個體可以獨立地站立和行走,但是步行和爬樓梯可能變得越來越困難。許多受影響的人將在以後的生活中需要輪椅協助。
IV型脊髓性肌萎縮症的症狀通常發生在30歲以後。受影響的個體通常經歷輕度至中度的肌肉無力,震顫,抽搐或輕度呼吸問題。通常,只有近端的肌肉,例如上臂和腿,在IV型脊髓性肌萎縮中受到影響。
X連鎖脊髓性肌萎縮的特徵出現在嬰兒期,包括嚴重的肌肉無力和呼吸困難。這類兒童常伴有運動損傷的關節攣縮,出生前肌肉張力不佳可能導致這些兒童的攣縮和骨折。
從成年早期到中期開始的成人發作的脊髓性肌萎縮形式影響近端肌肉,其特徵在於肢體和腹部的肌肉痙攣,腿部肌肉的無力,不自主的肌肉收縮,震顫和突出的腹部被認為與肌肉無力有關。一些受影響的個體會有吞嚥困難以及膀胱和腸功能的問題。
流行病學
脊髓性肌萎縮影響10,000人中的6,000比1。
基因醫學
在突變SMN1,UBA1,DYNC1H1和VAPB基因導致脊髓性肌萎縮。SMN2基因的額外拷貝改變了脊髓性肌萎縮的嚴重程度。
SMN1和SMN2基因提供了用於製備被稱為運動神經元存活(SMN)蛋白蛋白質的指令。SMN蛋白對維持稱為運動神經元的特化神經細胞很重要。運動神經元位於脊髓和腦幹中; 他們控制肌肉運動。大多數功能性SMN蛋白由SMN1基因產生,少量由SMN2基因產生。從SMN2基因產生幾種不同版本的SMN蛋白,但只有一種形式是全尺寸和功能性的。
SMN1基因的突變引起I,II,III和IV型脊髓性肌萎縮。SMN1基因突變導致SMN蛋白的短缺。如果沒有SMN蛋白,運動神經元會死亡,神經衝動不會在大腦和肌肉之間傳遞。結果,一些肌肉不能發揮其正常功能,導致虛弱和運動受損。
一些患有II型,III型或IV型脊髓性肌萎縮的人在每個細胞中具有三個或更多個SMN2基因拷貝。具有多個SMN2基因拷貝可以改變脊髓性肌萎縮的過程。由SMN2基因的額外拷貝產生的額外SMN蛋白可以幫助替換由於SMN1基因突變而丟失的一些SMN蛋白。一般而言,隨著SMN2基因拷貝數的增加,症狀不太嚴重並且在生命後期開始。
UBA1基因的突變導致X連鎖的脊髓性肌萎縮。所述UBA1基因提供了用於製備泛素激活?E1指令。該?參與靶向蛋白質在細胞內分解的過程。UBA1基因突變導致功能?水平降低或缺失,從而破壞蛋白質降解過程。細胞內蛋白質的積累會導致細胞死亡; 運動神經元特別容易受到蛋白質積聚的損害。
DYNC1H1基因提供了用於製備蛋白質被稱為動力蛋白蛋白質的組(複合物)的一部分的指令,這種複合物存在於細胞質,是移動蛋白質和其他材料的網絡的一部分。在神經元中,動力蛋白將細胞物質從神經元之間的突觸到細胞的中心。該過程有助於將化學信息從一個神經元傳遞到另一個神經元 DYNC1H1基因突變導致SMA-LED破壞動力蛋白複合物的功能。結果,細胞內蛋白質,細胞結構和其他物質的運動受到損害。控制肌肉運動的神經元之間化學信息傳遞的減少被認為是導致SMA-LED患者所經歷的肌肉無力的原因。目前尚不清楚為什麼這種情況只會影響下肢。
成人發病形式的脊髓性肌萎縮是由VAPB基因的突變引起的。所述VAPB基因提供了用於製備是在整個身體的細胞中發現的蛋白質的指令。研究人員表示,這種蛋白質可能在防止細胞內未折疊或錯誤折疊的蛋白質積聚方面發揮作用。尚不清楚VAPB基因突變如何導致運動神經元的喪失。受損的VAPB蛋白可能導致錯誤折疊和未折疊的蛋白質積累並損害運動神經元的正常功能。
主要影響小腿和腳以及下臂和手的其他類型的脊髓性肌萎縮是由脊髓神經元功能障礙引起的。當脊髓性肌萎縮表現出這種症狀和體徵模式時,它也被稱為遠端遺傳性運動神經病變。這種病症的各種類型是由其他基因的突變引起的。
遺傳類型
I,II,III和IV型脊髓性肌萎縮以常染色體隱性遺傳模式遺傳,這意味著每個細胞中的兩個SMN1基因拷貝都有突變。具有常染色體隱性病症的個體的父母每個攜帶一個突變基因的拷貝,但它們通常不顯示該病症的症狀。SMN2基因的額外拷貝是由於在卵子或精子細胞中或在受精後製造新的DNA拷貝(複製)時的隨機錯誤。
SMA-LED和由VAPB基因突變引起的晚髮型脊髓性肌萎縮以常染色體顯性遺傳方式遺傳,這意味著每個細胞中一個改變基因的拷貝足以引起疾病。
X連鎖脊髓性肌萎縮以X連鎖模式遺傳。所述UBA1基因位於上X染色體,這是在兩個性染色體中的一個。在雄性(只有一條X染色體)中,每個細胞中一個基因的改變拷貝就足以引起這種情況。在女性(有兩條X染色體)中,必須在基因的兩個拷貝中發生突變才能引起疾病。因為雌性不太可能有這種基因的兩個改變拷貝,所以雄性受X連鎖疾病的影響比雌性更頻繁。X連鎖遺傳的一個特徵是父親不能將X連鎖特徵傳遞給他們的兒子。
【 以上罕病介紹內容摘錄自National Institutes of Health 】
影音介紹:https://www.youtube.com/watch?v=mGaH3UKgxDE
2.彰基諮詢顧問醫師:
神經醫學部 – 劉青山、陳大成、陳彥宇
復健科 – 魏大森
3.遺傳診斷現況與發展:
彰化基督教醫院 基因醫學部 研究員/學術副主任 馬國欽 博士
脊髓性肌肉萎縮症(Spinal muscular atrophy, SMA)是一種體染色體隱性遺傳疾病,主要症狀為脊髓的前角運動神經元漸進性退化,導致肌肉逐漸軟弱無力及萎縮,嚴重者可危及生命。
SMA的引發是由於位於人類第五號染色體長臂5q11.2q13.3上的「運動神經元存活基因(Survival of motor neuron, SMN)」發生缺損或突變而無法產生有功能的蛋白質。一般人的兩條第五號染色體皆有兩個同源性很高的SMN基因:包括靠近染色體末端的SMN1與靠近染色體中節的SMN2。SMN1及SMN2基因都會進行轉錄,其中,SMN1基因可轉譯出穩定且功能完整的蛋白質;而SMN2基因序列與SMN1稍有差異,轉錄時可歷經「可變剪接(Alternative splicing)」,所產生的mRNA大部分(~90%)缺少第7號外顯子(Exon 7)序列,導致最後轉譯出來的蛋白質多為不穩定(圖一)。SMA的發生是由細胞中兩個拷貝數的SMN1基因都發生問題,但若只有其中一個拷貝數的SMN1基因帶有缺陷,則為帶因者(Carrier),本身並不會發病或有任何症狀,多數族群SMA帶因者比例約在1/25 - 1/50;而SMN2基因的拷貝數目則與SMA的臨床嚴重度有關,一般而言,SMN2基因拷貝數越少,症狀會越嚴重。SMA依照發病的早晚、嚴重度及預後不同則可區分為5型(表一)。
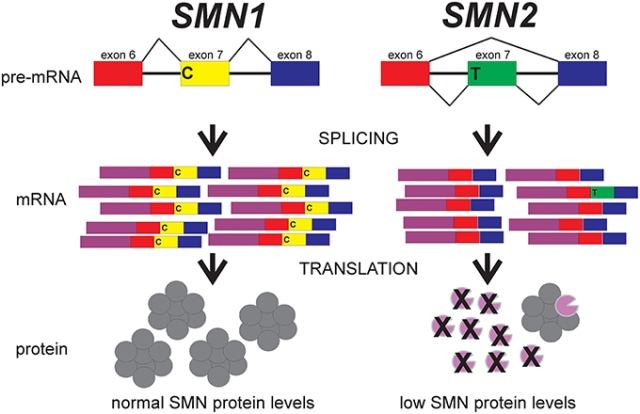
圖一、脊髓性肌肉萎縮症(SMA)相關基因。SMN1基因可轉錄轉譯出穩定且功能
完整的蛋白質,而SMN2基因所轉譯出來的蛋白質多為不穩定且不具功
能。前者與疾病發生有關,後者則與疾病嚴重度有關(圖片來源:
Butchbach, 2016 )。
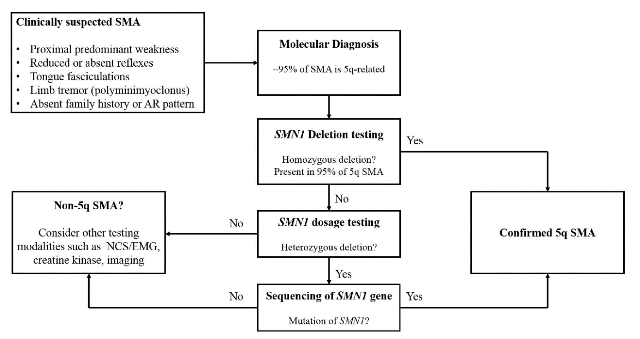
研究顯示,約95%的SMA患者導因於SMN1基因發生同合子缺失(Homozygous deletion),其餘患者則多是由一個SMN1拷貝的缺失,再加上另一個SMN1拷貝的序列突變所形成的複合型異合子(Compound heterozygote)變異所造成,因此SMA分子檢測,多先進行SMN1缺失檢測,若檢測結果排除SMN1同合子缺失,則需再進行基因劑量分析(Dosage analysis)與基因序列分析(DNA sequencing),以尋找可能的致病變異(圖二),目前僅有極少數SMA個案被證實是由於SMN1基因發生同合子序列突變所導致。SMA疾病嚴重度與分型,則需分析SMN2基因的拷貝數,一般健康人具有2 - 5個拷貝數的SMN2基因,但約有10%的健康人是不具有SMN2基因,但截至目前,並未發現任何患者同時在SMN1與SMN2基因發生完全缺失(SMN蛋白完全缺乏可能具有致死性)。分子檢測現階段已可用於SMA患者確認診斷與產前遺傳診斷,若搭配人工生殖技術,亦可進行胚胎植入前遺傳診斷(Preimplantation genetic screening, PGS)。
表一、脊髓性肌肉萎縮症(Spinal muscular atrophy, SMA)分型、發病年紀、
嚴重性及臨床表現。
|
疾病分型
|
疾病通稱
|
SMN1拷貝數
|
SMN2拷貝數
|
發病年紀
|
嚴重性
|
臨床表現
|
|
SMA 0
|
—
|
0
|
1
|
子宮內
|
極重度
|
胎兒活力低,常伴隨先天性心臟問題,胎兒或新生兒即死亡。
|
|
SMA I
|
Werdnig–
Hoffmann disease
|
0
|
2
|
出生半年內
(0-6個月)
|
重度
|
四肢及軀幹因嚴重肌張力減退而呈現四肢無力、哭聲無力及呼吸困難等症狀。一般在三歲前就會因呼吸衰竭而死亡。
|
|
SMA II
|
Dubowitz disease
|
0
|
3
|
幼兒期
(6-12個月)
|
中度
|
下肢呈對稱性之無力,無法自行站立及走路,肌腱反射消失或減弱,多數可依靠物理治療及呼吸照護存活至成年,少數在孩童期因呼吸道感染而死亡。
|
|
SMA III
|
Kugelberg–Welander disease
|
0
|
3-5
|
兒童期至青春期
(2-17歲)
|
輕度
|
輕度對稱之肢體近端肌肉無力,肌腱反射減弱。長期之存活率高。
|
|
SMA IV
|
—
|
0
|
3-5
|
成年
|
輕度至中度
|
輕度至中度的肌肉無力,震顫,抽搐或輕度呼吸問題。長期之存活率高。
|
4.營養團隊之建議:
彰化基督教醫院血管醫學防治中心 蔡玲貞 主任
彰化基督教醫院血管醫學防治中心 麥庭瑜 營養師
脊髓性肌肉萎縮症是一種神經肌肉疾病,特徵是讓脊髓α神經運動元退化,導致漸進式肌肉虛弱和癱瘓,所以此類患者漸漸都有吞嚥困難的問題。由於咀嚼肌疲勞或痙攣都會使患者食物攝入量減少、延長進食時間,而反覆呼吸道感染,長期更將導致營養不良。脊髓性肌肉萎縮症營養處置的目標為維持足夠營養、預防吸入性肺炎。
為維持足夠的營養,熱量建議為嬰兒100 kcal/kg/天、兒童70 kcal/kg/天、增加複合醣類的攝取,包括飯或麵類、蛋白質攝取量至少1-2公克/公斤/天、避免脂肪攝取過多,但必需脂肪酸需攝取足量,約佔總熱量之5%、避免夜間禁食過久,兩餐餵食時間嬰兒避免超過6小時、幼童避免超過10-12小時,最重要的是要搭配適度的運動,讓肌肉適時伸展。患者臨床症狀包括進食易嗆咳、咀嚼能力降低、進食速度慢、唾液分泌增加等,所以飲食供應建議包括選擇質地易消化的食物、少量多餐、避免有碎屑之食物、液體適時添加增稠劑、補充高熱量高蛋白、濃縮食物、防止刺激性辣、酸、麻等食物等。脊髓性肌肉萎縮症患者應即早給予營養介入,避免患者體重下降和營養不良之狀況。
5.中醫之建議:
彰基中醫部 邱重閔 醫師
脊髓性肌肉萎縮症的症狀重點就於肌肉萎縮無力,雖然有些患者合併出現肌肉拘攣、震顫,但是肌肉無力、疲勞、甚至頭暈等是為主要症狀。清朝的醫宗金鑑提到: "五痿,肝、心、脾、肺,腎之痿也。痿屬燥病,皆因肺熱而生。"確實臨床上看到不少肌肉無力的病人容易皮膚乾燥,或呈現舌脈皆燥的症候。治療上無法單純從肺熱來治療,須兼顧其脾腎虛損現象,即要強健其消化能力(脾),補腎填精(腎)。
另外脊椎的角度也是治療重點,良好的脊椎角度可以短期內改善其疲勞或使用肌肉的方式,使其更有效率地應用核心肌群,來控制軀幹或四肢的活動,所以建議配合復健或整脊的治療或姿勢調整,方能保全健康。
檔案下載-彰基罕病電子報 電子報(第十六期)--Spinal muscular atrophy 脊髓性肌肉萎縮症(全文)